今天,好老师升学帮为大家带来的是2023年湖北文理学院专升本《分析化学》考试大纲及样卷。报考湖北文理学院专升本化学专业的同学要好好查看相关内容哦。
《分析化学》考试大纲
一、考试目的和性质
为挑选化学及相近学科专业专科生中优秀的学生进入普通高等学校本科插班学习,特举行此具有选拔功能的水平考试。本考试的指导思想是既要有利于国家对高层次人材的选拔,又要有利于促进高等学校各类课程教学质量的提高,具有对学生把握本课程程度的较强识别、区分能力。
本课程基本要求分为掌握、熟悉和了解三个层次:“掌握”的内容要求理解透彻,能在本学科和相关学科的学习工作中熟练、灵活运用其基本理论和基本概念;“熟悉”的内容要求能熟知其相关内容的概念及有关理论,并能适当应用;“了解”的内容要求对其中的概念和相关内容有所了解。
二、考试方式
闭卷笔试,满分为100分。
三、试卷结构
试卷命题范围应涵盖课程的所有章节,试题难易程度分为,较易占50%,中等难度占30%,较难占20%。
四、考试主要内容
第一章 绪论
(一)考试内容:
1、分析化学的任务与作用分析化学发展史
2、分析化学方法的分类
3、分析化学的进展简况
(二)基本要求
1、 明确本课程的研究对象、地位、性质与任务等。
2、了解分析化学的分类及最新发展,明确课程的重要性。
3、明确本课程的学习内容与学习方法。
第二章 误差及分析数据的统计处理
(一)考试内容
1、定量分析中的误差
误差和偏差的表示方法以及与准确度和精密度的关系。
2、分析结果的数据处理
对有限测定数据进行统计处理的基本方法:置信度、置信区间及t分布的含义以及μ的置信区间计算;用t检验法检验样本平均值与标准值之间是否存在显著性差异 ,从而判断测定结果或分析方法的可靠性;用Q检验法和格鲁布斯法判断可疑值的取舍。
3、有效数字及其运算规则
有效数字的判断,修约规则和有效数字的加减乘除计算。
4、标准曲线的回归分析
标准曲线方程;变量之间关系的相关与回归分析。
5、提高分析结果准确度的方法
(二)基本要求
1、掌握与误差有关的一些基本概念、误差的产生原因及减免方法、准确度和精密度的表示方法及有关计算和有效数字的修约规则及运算规则。
2、熟悉显著性检验的目的和方法,可疑数据的取舍方法,置信区间的含义及表示方法。
3、了解误差的分布、传递规律和处理变量之间关系的统计方法-相关与回归。
第3章 滴定分析
(一)考试内容
1、滴定分析概述
2、滴定分析的分类与滴定反应的条件
3、 标准溶液
4、标准溶液浓度表示法
5、滴定分析结果的计算
(二)基本要求
1、熟练掌握标准溶液的配制和标定;
2、掌握标准溶液浓度表示法。
3、熟练掌握滴定分析中的计算。
第4章 酸碱滴定法
(一)考试内容
1、酸碱平衡的理论基础
2、不同pH溶液中酸碱存在形式的饿分布情况-分布曲线
3、酸碱溶液的H+浓度计算
4、酸碱滴定终点的指示方法
5、一元酸碱的滴定
6、多元酸、混合酸和多元碱的滴定
7、酸碱标准溶液的配置与标定
8、酸碱滴定法结果计算示例
(二)基本要求
1、了解酸碱强度与溶剂的关系
2、掌握分布系数以及处理酸碱平衡的方法;
3、掌握酸碱平衡中的pH值的计算;掌握酸碱水溶液中氢离子浓度的计算方法(近似式和最简式)。
4、掌握酸碱滴定的基本原理。掌握酸碱滴定中氢离子浓度的变化规律。重点掌握强酸、强碱相互滴定和强碱滴定弱酸的滴定曲线,既掌握化学计量点及±0.1%准确度(滴定突跃),pH值计算。
5、掌握酸碱指示剂指示终点的原理与选择原则。掌握几种常见缓冲溶液的配置方法,了解缓冲范围和缓冲容量的概念。
6、掌握准确滴定及分步滴定的条件和分析结果的计算;
7、了解酸碱滴定法的应用。
第5章 配位滴定法
(一)考试内容
1、概述
2、EDTA与金属离子的配合物及其稳定性
3、外界条件对EDTA于金属离子配合物稳定性的影响
4、滴定曲线
5、金属指示剂及其他指示终点的方法
6、混合离子的分别滴定
7、配位滴定的方式和应用
(二)基本要求
1、了解EDTA及金属离子络合的特点。
2、了解副反应、酸效应、络合效应、稳定常数及条件稳定常数等概念。
3、掌握金属离子能够对准确滴定的判别式,根据酸效应曲线掌握滴定金属离子最高允许酸度的计算。
4、了解金属离子指示剂的作用原理。
5、了解提高络合滴定选择性的方法,了解络合滴定各种方式的特点与应用。
6、掌握络合滴定结果的计算。
第6章 氧化还原滴定法
(一)考试内容
1、氧化还原反应平衡
2、氧化还原反应进行的程度
3、氧化还原反应的速率与影响因素
4、氧化还原滴定曲线及终点的确定
5、氧化还原滴定法中的预处理
6、高锰酸钾法
7、重铬酸钾法
8、碘量法
9、其他氧化还原滴定法
10、氧化还原滴定结果的计算
(二)基本要求
1、了解条件电极电位的意义与应用。
2、了解氧化还原滴定过程中电极电位和离子浓度的变化规律,了解选择指示终点的适当方法。
3、掌握高锰酸钾法、重铬酸钾法和碘量法的原理、有关标准溶液的配置与标定及应用。
4、掌握化学计量点电位(对称电对参加反应)及滴定结果的计算。
第7章 重量分析法和沉淀滴定法
(一)考试内容
1、重量分析法概述
2、重量分析对沉淀的要求
3、沉淀完全的程度与影响沉淀溶解度的因素
4、影响沉淀纯度的因素
5、沉淀的形成和沉淀的条件
6、重量分析的计算和应用示例
7、沉淀滴定法概述
8、银量法滴定终点的确定
9、滴定分析小结
(二)基本要求
1、了解重量分析对沉淀的要求、沉淀形成过程,理解影响沉淀溶解度的因素。
2、了解影响沉淀纯度的因素及提高沉淀纯度的措施。
3、掌握晶形沉淀与非晶形沉淀的形成条件。
4、掌握重量分析结果的计算。
5、掌握摩尔法、佛尔哈德法和发扬斯法的原理和应用。
第八章 吸光光度法
(一)考试内容
1、吸光光度法基本原理
2、光度计及其基本部件
3、显色反应及显色条件的选择
4、吸光度测量条件的选择
5、吸光光度法的应用
6、紫外吸收光谱法简介
(二)基本要求
1、理解朗伯-比尔定律的数学表达式及意义、摩尔吸光系数的意义和计算。
2、了解选择显色剂的原理及及影响显色反应的因素。
3、掌握分光光度法的基本原理应用。
参考书目:
华东理工大学化学系、四川大学化工学院编,《分析化学》(第七版),高等教育出版社,2018.
《分析化学》考试样卷
选择题(每题有四个备选项,从中选出一个正确答案。每小题2分,共100分)
1、下列论述中正确的是( )
A、系统误差呈正态分布 B、偶然误差具有单向性
C、置信度可以自由度来表示 D、标准偏差用于衡量测定结果的分散程度
2、下列论述中,有效数字位数错误的是( )
A、 [H+] = 1.50×10-2(3 位)B、c = 0.1007mol·L-1(4 位)
C、lgKCa-Y = 10.69(4 位)D、pH = 8.32(2 位)
3、在对一组分析数据进行显著性检验时,若已知标准值,则应采用( )
A、t 检验法 B、F 检验法 C、Q 检验法 D、u 检验法
4、根据滴定管的读数误差(0.01mL)和测量的相对误差(0.1%),要求滴定时所消耗的滴定剂体积 V 应满足( )
A、V≤10mL B、10mL<V<15mL C、V≥20mL D、V<20mL
5、偏差是衡量( )
A、精密度 B、置信度 C、准确度 D、精确度
6、误差是衡量( )
A、精密度 B、置信度 C、准确度 D、精确度
7、定量分析中精密度和准确度的关系是( )
A、准确度是保证精密度的前提 B、精密度是保证准确度的前提
C、分析中,首先要求准确度,其次才是精密度
D、分析中,首先要求精密度,其次才是准确度
8、试液体积在 1 ~ 10 mL 的分析称为 ( )
A、常量分析 B、半微量分析 C、微量分析 D、痕量分析
9、准确移取 1.0 mg/mL 铜的标准溶液 2.50 mL,于容量瓶中稀释至 500 mL, 则稀释后的溶液含铜( g/mL)为 ( )
A、0.5 B、2.5 C、5.0 D、25
10、用三乙醇胺(pKb = 6.24)配成的缓冲溶液,其 pH 缓冲范围是( )
A、3~5 B、4~6 C、5~7 D、7~9
11、用 0.10mol·L-1 的 NaOH 滴定 0.10mol·L-1,pKa=3.0 的弱酸,其 pH 突跃范围是 7.0~9.7,用同浓度的 NaOH 滴定 0.10mol·L-1,pKa=4.0 的弱酸时,其 pH 突跃范围将是( )
A、8.0~9.7 B、7.0~10.0 C、6.0~9.7 D、6.0~10.7
12、用纯水把下列溶液稀释 10 倍时,其中 pH 值变化最小的是( )
A、0.1mol·L-1 HCl 溶液 B、0.1mol·L-1 NH3·H2O
C、0.1mol·L-1 HAc 溶液 D、1mol·L-1 HAc + 1mol·L-1 NaAc 溶液
13、用强碱滴定弱酸时,应选用的指示剂是( )
A、甲基橙 B、酚酞 C、甲基红 D、溴酚蓝
14、下列各组酸碱物质中,属于共轭酸碱对的是( )
A、H3PO4 - Na2HPO4 B、H2CO3 - CO32-
C、(CH2)6N4H+ - (CH2)6N4 D、NH3+CH2COOH – NH2CH2COO-
15、下列 0.10mol·L-1的碱能用HCl直接滴定的是( )
A、六次甲基四胺(pKb = 8.85) B、三乙醇胺(pKb = 6.24)
C、苯甲酸钠(pKa = 4.21)D、氨水(pKb = 4.74)
16、用 0.10mol·L-1HCl 滴定 0.10mol·L-1 NH3至计量点的质子条件式是( )
A、[H+]=[OH- ]+0.05-[NH3] B、[H+]=[OH-]-0.05+[NH4+]
C、[H+]=[OH- ]+[NH3] D、[H+]=[OH- ]+0.05-[NH4+]
17、当 M 与 Y 反应时,溶液中有另一络合物 L 存在,若aM(L)>1,则表示( )
A、M 与Y 没有副反应 B、可以忽略M 与Y的副反应
C、M 与Y有副反应 D、[M] = [M']
18、当用 EDTA 直接滴定无色金属离子时,终点呈现的颜色是( )
A、游离指示剂的颜色 B、EDTA -金属离子络合物的颜色
C、指示剂-金属离子络合物的颜色 D、上述 A 与 B 的混合色
19、入射光的波长会影响有色络合物的( )
A、稳定常数 B、浓度 C、活度 D、摩尔吸光系数
20、比色分析中,用 2cm 的比色皿测得透光率为 T,若改用 1cm 的比色皿测得的透光率为( )
A 2T B T/2 C T2 D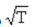
21、已知某些显色体系的桑德尔灵敏度S为0.022g/cm2,Cu 的相对原子质量为63.35,则吸光系数(L/g·cm)为( )
A、45.5 B、55.5 C、110 D、11.0
22、在 A = abc 方程式中,当 c 以 mol·L-1 表示,b 以 cm 表示时,a 称为( )
A、摩尔吸光系数 B、吸光系数 C、桑德尔指数 D、比例系数
23、紫外及可见吸收光谱由( )
A、原子外层电子跃迁产生 B、分子振动和转动产生
C、价电子跃迁产生 D、电子能级振动产生
24、从标准曲线上查得的 Mn2+浓度为0.400mg·mL-1 时,吸光度As=0.360,若未知液吸光度Ax=0.400,则未知液中Mn2+的浓度(mol·mL-1)为:( )
A、0.480 B、0.550 C、0.600 D、0.444
25、在络合滴定法中,准确滴定必须满足的条件是( )。
A、cKMY≥10-8 B、cK′MY≥10-8 C、cKMY≥106 D、cK′MY≥106
26、在络合滴定法中,溶液的 pH 值应满足的条件为( )。
A、高于最高酸度的 pH 值,低于最低酸度的 pH 值
B、低于最高酸度的 pH 值,高于最低酸度的 pH 值
C、高于最高酸度的 pH 值即可
D、低于最高酸度的 pH 值即可
27、用 EDTA 标准溶液中滴定 Ca2+,为避免共存 Mg2+的影响,可采用的方法是( )。
A、加入少量 Mg-EDTA B、加入大量 NH4F
C、在强碱性条件下滴定 D、在强酸性条件下滴定
28、与仪器分析法相比,化学分析法的优点是( )。
A、准确度高 B、灵敏度高 C、分析速度快 D、样品用量少
29、用双指示剂法测定混合碱,若 V1=V2,试样组成为( )
A、NaOH B、NaHCO3 和 Na2CO3 C、Na2CO3 D、NaHCO3
30、使用铬黑 T 指示剂合适的 pH 范围是( )
A、8~10 B、1~5 C、5~7 D、10~12
31、以下物质必须采用间接法配制标准溶液的是( )
A、K2Cr2O7 B、KMnO4 C、Zn D、H2C2O4•2H2O
32、EDTA与金属离子形成螯合物时,螯合比大多为( )
A、1:1 B、1:2 C、1:3 D、2:1
33、磷酸的pKa1、pKa2、pKa3分别为2.12、7.20、12.36,在pH=1.0的磷酸溶液中,磷酸的主要存在形体为( )
A、磷酸根 B、磷酸一氢根 C、磷酸二氢根 D、磷酸分子
34、下列哪种方法不属于氧化还原滴定法( )
A、KMnO4法 B、碘量法 C、银量法 D、K2Cr2O7法
35、查表可知有关电对的标准电极电势如下:
MnO4-/Mn2+ 1.51V Cr2O72-/Cr3+ 1.33V Cu2+/Cu 0.34V Fe3+/ Fe2+ 0.77V
下列说法中那个是正确的
A、氧化能力大小顺序为:K2Cr2O7 >KMnO4>FeCl2>CuCl2
B、还原能力大小顺序为:MnSO4>CuCl2> FeCl3>CrCl3
C、氧化能力大小顺序为:KMnO4>K2Cr2O7>FeCl3>CuCl2
D、还原能力大小顺序为:KMnO4>K2Cr2O7>FeCl3>CuCl2
36、用邻苯二甲酸氢钾(KHC8H4O4)为基准物,标定0.1 mol/L NaOH溶液,每份基准物的称取质量范围宜为( )[M(KHC8H4O4)=204.2]
A、0.8-1.6g B、0.4-0.8g C、0.2-0.4g D、0.2g
37、符合朗伯-比尔定律的一有色溶液,当有色物质的浓度增加时,最大吸收波长和吸光度分别是 ( )
A、不变、增加 B、不变、减少 C、增加、不变 D、减少、不变
38、下列哪种情况应采用返滴定法( )。
A、用AgNO3标准溶液测定NaCl试样含量
B、用HCl标准溶液测定Na2CO3试样含量
C、用EDTA标准溶液测定Al3+试样含量
D、用Na2S2O3标准溶液测定K2Cr2O7试样含量
39、下列各项叙述中不是滴定分析对化学反应要求的是( )。
A、有确定的化学计量关系 B、反应必须完全
C、反应速度要快 D、反应物的摩尔质量要大
40、在用K2Cr2O7法测定Fe时,加入H3PO4的主要目的是 ( )
A、提高酸度,使滴定反应趋于完全
B、降低化学计量点前Fe3+/Fe2+电对的电位,使二苯胺磺酸钠在突跃范围内变色
C、提高化学计量点前Fe3+/Fe2+电对的电位,使二苯胺磺酸钠不致提前变色
D、有利于形成 Hg2Cl2 白色丝状沉淀
41、测定试样中CaO的质量分数,称取试样0.9080 g,滴定耗去EDTA标准溶液20.50 mL, 以下结果表示正确的是 ( )
A、10% B、10.1% C、10.08% D、10.077%
42、某溶液含Ca2+、Mg2+及少量Al3+、Fe3+,今加入三乙醇胺, 调至pH=10,以铬黑T为指示剂,用EDTA滴定,此时测定的是 ( )
A、Ca2+,Mg2+总量 B、Ca2+量 C、Mg2+量 D、Ca2+,Mg2+,Al3+,Fe3+总量
43、人眼能感觉到的光称为可见光,其波长范围是 ( )
A、200~320nm B、400~780nm C、200~780nm D、200~1000nm
44、直接与金属离子配位的EDTA型体为( )
A、H6Y2+ B、H4Y C、H2Y2- D、Y4-
45、误差的分类为( )
A、偶然误差、方法误差 B、系统误差、方法误差
C、随机误差、系统误差 D、方法误差、操作误差
46、下列物质可以作为基准物质的是( )
A、NaHCO3 B、K2Cr2O7 C、NaOH D、KMnO4
47、标定碱标准溶液的浓度,常用的基准物质是( )。
A、邻苯二甲酸氢钾 B、Na2B4O7.10H2O C、无水Na2CO3 D、H2SO4
48、属于晶形沉淀所要求的沉淀条件是( )
A、较浓的溶液 B、冷溶液 C、不断搅拌下快速加入 D、陈化
49、氧化还原滴定中可作为自身指示剂的标准溶液有( )
A、Na2C2O4 B、H2SO4 C、KMnO4 D、MnSO4
50、已知lgKCaY=10.69, 在pH=9.0 的氨性缓冲溶液中[lgα(H)=1.29], K´CaY为( )
A、101.29 B、10-9.40 C、109.40 D、1011.96
 抖音
抖音

 微信
微信

 微博
微博

 QQ群
QQ群

 400-023-1785
400-023-1785